�M�͊w���@��
�y�L���z��������L���ł��B�����̊F���܂̂��x�������������肽���A��낵�����肢�������܂��B
�y�L���z�L���͂����܂łł��B
�O���ɉ��̉e�����^���邱�ƂȂ����̏�Ԃɖ߂����Ƃ��ł��Ȃ��ω����s�t�ω��ƌ����B
�M�̈ړ����s�t�ω��ł����āA�����̕�������ቷ�̕����ւƈړ����A�M�����ɖ߂邱�Ƃ͂Ȃ��A�Ƃ����@�����A�M�͊w���@���ƌ����B
�M�Ɋւ��錻�ۂ͑S�Č����ɂ͕s�t�ω��ł��邱�Ƃ��m���Ă��܂��B�t�ω��ƍl����ꍇ�����z�����ꂽ�ōl���Ă���̂ł��B
���ɁA�����̕����ƒቷ�̕�����ڐG�����Ă����ƁA�M�́A�����̕�������ቷ�̕����Ɏ����I�Ɉړ����܂����A�O�����牽�炩�̑�����s��Ȃ�����A�ቷ�̕������獂���̕������M���ڂ邱�Ƃ͂���܂���B������M�͊w���@���ƌ����܂��B�O������̑���A�Ƃ����̂́A�①�ɂ�G�A�R���ł͒ቷ�̕��̂����M��D�����߂ɁA�R���v���b�T�[�ŋC�̂̈��k���s���ߒ���K�v�Ƃ���A�Ƃ������Ƃł��B
�M�͊w���@���ɂ́A�������̈قȂ�\���̎d�����m���Ă��āA��L�̕\�����N���E�W�E�X�̌����ƌ����܂��B
�M�͊w���@�����A�������x�̕������琳���M��D���Ă�������ׂĊO���ɑ��鐳���d���ɕϊ����邱�Ƃ͂ł��Ȃ��A�ƕ\������Ƃ��A�g���\���̌����ƌ����܂��B
pV�}�œ����Ȑ���V���ň͂ޖʐς��C�̂̂����d���ɂȂ�܂����A��������ׂĊO���ւ��d���ɂ��邽�߂ɂ́A�i���ɋC�̂��c���������Ȃ��Ă͂����܂���B����͂��蓾�Ȃ��A�Ƃ����̂��g���\���̌����ł��B
�܂��A�ǂ����Ŗc������ߍŏ��̏�Ԃɖ߂�Ƃ���ƁA��Η�x�̓����ω�(�C�̂������d�����[��)���o�邱�ƂɂȂ�܂��B�@���(��)�@�ł����A����͕s�\���A�Ƃ������Ƃł��B
��艷�x�̔M�������M��D���ĉi�����d����������M�@�ւ����i�v�@�ւƌ����܂����A�g���\���̌����ɂ��A����i�v�@�ւ̎����͕s�\�ł��B
�܂��A�M�͊w���@����M����1�̔M�@�ւ̎����͕s�\�ł���A�ƁA�\�����邱�Ƃ��ł��܂��B(��)�̂悤�ȋ@�ւ��ł���A�M������z�������M �����ׂ��d��W�ɕϊ�����(��Η�x�������ω��ŋC�̂������d���̓[��)�̂ŁA�M�����́A
�����ׂ��d��W�ɕϊ�����(��Η�x�������ω��ŋC�̂������d���̓[��)�̂ŁA�M�����́A �ł��B�g���\���̌�����肱��͕s�\�ł��B
�ł��B�g���\���̌�����肱��͕s�\�ł��B
�������ŔM������1�ɂȂ��Ă��܂��Ƃ��́A���������̊��Ⴂ(�Ⴆ�A�J���m�[�E�T�C�N���ł́A��M���Ɏ̂Ă��M�� �Ƃ��āA�C�̂̂����d���́A
�Ƃ��āA�C�̂̂����d���́A �ƂȂ�܂����A
�ƂȂ�܂����A �Ŋ��炸�ɁA
�Ŋ��炸�ɁA �Ŋ����āA
�Ŋ����āA �Ƃ��Ă��܂��~�X���悭�������܂�)�����Ă���̂ł悭�������悤�ɂ��Ă��������B
�Ƃ��Ă��܂��~�X���悭�������܂�)�����Ă���̂ł悭�������悤�ɂ��Ă��������B
���āAn���������z�C���ɂ��āA���A(���x�F �C�̐��F
�C�̐��F )�C���B(���x�F
)�C���B(���x�F �C�̐��F
�C�̐��F )�C���C(���x�F
)�C���C(���x�F �C�̐��F
�C�̐��F )�C���D(���x�F
)�C���D(���x�F �C�̐��F
�C�̐��F )�C�A��
)�C�A�� �C�Ƃ��āAA��B�������ω��AB��C���f�M�ω��AC��D�������ω��AD��A���f�M�ω��A�ƂȂ�A��B��C��D��A�ƈꏄ�����J���m�[�E�T�C�N���@���������Ƃ��܂��B�T�C�N���@�ł́A���ׂĂ̕ω��͏��ÓI�ߒ��ł���t�ω����Ƃ��܂��B�܂��AA��B�̉ߒ��ŋC�̂����M������z�������M��
�C�Ƃ��āAA��B�������ω��AB��C���f�M�ω��AC��D�������ω��AD��A���f�M�ω��A�ƂȂ�A��B��C��D��A�ƈꏄ�����J���m�[�E�T�C�N���@���������Ƃ��܂��B�T�C�N���@�ł́A���ׂĂ̕ω��͏��ÓI�ߒ��ł���t�ω����Ƃ��܂��B�܂��AA��B�̉ߒ��ŋC�̂����M������z�������M�� (
( )�CC��D�̉ߒ��ŋC�̂���M���ɔr�o�����M��
)�CC��D�̉ߒ��ŋC�̂���M���ɔr�o�����M�� (
( )�C�T�C�N���@�ŋC�̂��O���ɂ����d����W�Ƃ��܂��B�|�A�b�\���̊W�����A
)�C�T�C�N���@�ŋC�̂��O���ɂ����d����W�Ƃ��܂��B�|�A�b�\���̊W�����A
�M�����́A �ł��B
�ł��B
����ɑ��āA�J���m�[�E�T�C�N���@�̂ǂ������s�t�ω��ɂȂ��Ă���T�C�N���A���l���A�C�̂����x �̍��M������z�������M��
�̍��M������z�������M�� (
( )�C���x
)�C���x �̒�M���ɔr�o�����M��
�̒�M���ɔr�o�����M�� (
( )�Ƃ��܂��B�M������
)�Ƃ��܂��B�M������ �ł��B
�ł��B
�T�C�N���@�͉t�ω��Ȃ̂ŋt�ߒ� (A��D��C��B��A)�����݂��܂��B�T�C�N��
(A��D��C��B��A)�����݂��܂��B�T�C�N�� �ł́A�C�̂͊O�������d��W������Ē�M������M
�ł́A�C�̂͊O�������d��W������Ē�M������M ���z�����č��M�����M
���z�����č��M�����M ��r�o���܂��B�����ŁA�T�C�N��
��r�o���܂��B�����ŁA�T�C�N�� �ƃT�C�N���A�����킹���T�C�N�����l���܂��B���̃T�C�N���ł́A�C�̂��d��W��������d��W������̂��d�������܂���B�܂��A��M�������M
�ƃT�C�N���A�����킹���T�C�N�����l���܂��B���̃T�C�N���ł́A�C�̂��d��W��������d��W������̂��d�������܂���B�܂��A��M�������M ���z�����č��M�����M
���z�����č��M�����M ��r�o���܂��B���̃T�C�N���ł́A�d���������G�l���M�[�̕ω����[���Ȃ̂��M�͊w���@�����
��r�o���܂��B���̃T�C�N���ł́A�d���������G�l���M�[�̕ω����[���Ȃ̂��M�͊w���@����� �ł��B���ɁA
�ł��B���ɁA ���Ƃ���ƁA�O�����牽��̑�����s��Ȃ��̂ɁA�ቷ�̕������獂���̕������M���ڂ邱�ƂɂȂ�A�M�͊w���@���ɔ����܂��B�]���āA
���Ƃ���ƁA�O�����牽��̑�����s��Ȃ��̂ɁA�ቷ�̕������獂���̕������M���ڂ邱�ƂɂȂ�A�M�͊w���@���ɔ����܂��B�]���āA �ł��B�܂��A
�ł��B�܂��A �̂Ƃ��ɂ́A�T�C�N���A�̓T�C�N���@�ƈ�v���A�T�C�N���A�͉t�ω��ƂȂ��ĕs�t�ω��ł͂Ȃ��Ȃ�܂��B�܂�A�J���m�[�E�T�C�N���̂ǂ������s�t�ω��ɂȂ��Ă���ƁA
�̂Ƃ��ɂ́A�T�C�N���A�̓T�C�N���@�ƈ�v���A�T�C�N���A�͉t�ω��ƂȂ��ĕs�t�ω��ł͂Ȃ��Ȃ�܂��B�܂�A�J���m�[�E�T�C�N���̂ǂ������s�t�ω��ɂȂ��Ă���ƁA �C�܂�A
�C�܂�A �ł����āA
�ł����āA �ł��B������A�M�����ɂ��āA
�ł��B������A�M�����ɂ��āA
 �@����C
�@����C ��������̂́A���ׂẲߒ����t�ω��ɂȂ�ꍇ�ł�(������J���m�[�̒藝�ƌ����܂�)�B
��������̂́A���ׂẲߒ����t�ω��ɂȂ�ꍇ�ł�(������J���m�[�̒藝�ƌ����܂�)�B
�܂��A�B�C�C���A �ł����āA
�ł����āA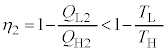 �ƂȂ�̂ŁA
�ƂȂ�̂ŁA
 �@��
�@�� 
�ƂȂ�܂��B�����ŁA �Ƃ����ʂɒ��ڂ��āA�M�͊w�̏�Ԃ��l���邱�Ƃ��ł���̂ł����A������G���g���s�[�ƌ����܂��B
�Ƃ����ʂɒ��ڂ��āA�M�͊w�̏�Ԃ��l���邱�Ƃ��ł���̂ł����A������G���g���s�[�ƌ����܂��B
��w�����͈̔͂ł͂���܂��A�����̏d�v�T�O���G���g���s�[�Ƃ����T�O������܂��B�ΏۂƂȂ�����ɕ����ɂ���Ƃ��ɁA�G���g���s�[�͒Ⴍ�A���ω�����Ă���ƃG���g���s�[�͍����Ȃ�܂��B
�T�C�R����1��U����3���o���Ƃ��܂��B���̂Ƃ��́A3�������o�Ă��āA1�C2�C4�C5�C6�͏o�Ă��܂���A���ɕ����ɂ���̂ŁA�G���g���s�[�͒Ⴂ��Ԃł��B����ɑ��āA�T�C�R����U��𑝂₵�Ă����A6����U��ƁA1�C2�C3�C4�C5�C6�̊e�ڂ̏o��́A�ǂ̖ڂ���������1���炢�ŕ��ω����ꂽ�ɂȂ�܂��B����̓G���g���s�[��������Ԃł��B�����A3��5��4���o�āA���̖ڂ�1000�����o�Ȃ��Ȃ�A����̓G���g���s�[�̒Ⴂ��Ԃł��B
�M�ɂ��A�T�C�R���̖ڂ̏o���Ǝ����悤�Ȑ���������A�M�͊w���@�����A�Ǘ������n(�G�l���M�[�╨���̏o���肪�Ȃ��n)�ɂ����ẮA�s�t�ω��ɂ����ăG���g���s�[�͑��債�Ă���(�t�ω��ł̓G���g���s�[�͕ω����Ȃ�)�A�Ƃ����悤�ɕ\�����邱�Ƃ��ł��܂��B
�y�L���z��������L���ł��B�����̊F���܂̂��x�������������肽���A��낵�����肢�������܂��B
�y�L���z�L���͂����܂łł��B
�@�@������b����TOP�@�@����TOP�@�@TOP�y�[�W�ɖ߂�
�y�L���z��������L���ł��B�����̊F���܂̂��x�������������肽���A��낵�����肢�������܂��B
�y�L���z�L���͂����܂łł��B
�e���̒��쌠��
�o���w�ɑ����܂��B©2005-2024(�L)����� ��w�y�w�m ���������t���I���n��w�l�b�g�m��w�y�w�m(���ē���������)������́A
�܂��A������܂Ń��[����
�����肭�������B  �Ƃ��Ă��܂��~�X���悭�������܂�)�����Ă���̂ł悭�������悤�ɂ��Ă��������B
�Ƃ��Ă��܂��~�X���悭�������܂�)�����Ă���̂ł悭�������悤�ɂ��Ă��������B )�CC��D�̉ߒ��ŋC�̂���M���ɔr�o�����M��
)�CC��D�̉ߒ��ŋC�̂���M���ɔr�o�����M�� )�C�T�C�N���@�ŋC�̂��O���ɂ����d����W�Ƃ��܂��B�|�A�b�\���̊W�����A
)�C�T�C�N���@�ŋC�̂��O���ɂ����d����W�Ƃ��܂��B�|�A�b�\���̊W�����A
 �C
�C �@����B
�@����B �ł��B
�ł��B �ł��B
�ł��B �@����C
�@����C ��������̂́A���ׂẲߒ����t�ω��ɂȂ�ꍇ�ł�(������J���m�[�̒藝�ƌ����܂�)�B
��������̂́A���ׂẲߒ����t�ω��ɂȂ�ꍇ�ł�(������J���m�[�̒藝�ƌ����܂�)�B �ł����āA
�ł����āA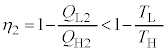 �ƂȂ�̂ŁA
�ƂȂ�̂ŁA �@��
�@�� 
