原子
【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。
古代ギリシャにおいて、デモクリトスらが、物質を構成する最小単位でこれ以上分割不可能なものを「アトム」として哲学的に議論していました。しかし、原子という概念は以降長い間忘れ去られていました。
ニュートンが運動方程式で持ち出した「質量」という概念に基づいて、1774年フランスのラボアジェが、化学反応における質量保存の法則を発見し、燃焼による質量増加を酸素との結合によって説明しました。20世紀の相対性理論の登場まで、化学反応では、物質の元素の構成は変わるが、物質そのものは不滅だという確信ができていました。
1799年フランスのJ.L.プルーストは、水の質量が、酸素の質量8,水素の質量1の割合でできていること、金属酸化物などの化合物の質量が、元素の質量の簡単な整数倍の比で構成されていることを示しました。19世紀に入り、分圧の法則を発見したイギリスのドルトンが、「原子量」を提唱し、各元素の質量を、水素分子の質量を1として、それに対する比として決めていきました。これにより、分子の質量を、元素質量の簡単な整数倍の組み合わせとして決めることができました。1808年フランスのゲイリュサックが、気体反応は、同温同圧のもと、簡単な体積比で起こる、例えば、酸素の体積1に対して水素の体積2の割合で反応すると体積1の水が生ずることを発見しました。
1811年イタリアのアボガドロは、酸素・水素・窒素は2原子で1分子となること、気体の体積は、同温同圧のもと、気体の種類によらず原子数・分子数に比例すること主張しました。アボガドロの仮説の実証は1860年になってからです。アボガドロ数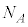 は1865年に測定されました。アインシュタインのブラウン運動の理論(1905年)を検証していたフランスのペランによって、アボガドロ数が
は1865年に測定されました。アインシュタインのブラウン運動の理論(1905年)を検証していたフランスのペランによって、アボガドロ数が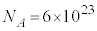 と求められたのは1908年になってからです。
と求められたのは1908年になってからです。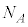 を「アボガドロ数」とペランが命名したのは1909年です。
を「アボガドロ数」とペランが命名したのは1909年です。
1817年ドイツのデーベライナーは、同様の化学的性質を有する元素、Ca(原子量40),Sr(原子量88),Ba(原子量137)の原子量が48間隔で並んでいるという規則性があることに気づきました。1829年には他にも、Cl,Br,Iの組、Li,Na,Kの組、S,Se,Teの組が原子量に規則性を持っていることを発見しました。この後、元素の周期性が次々と発見され、1869年ロシアのメンデレーエフが、それまでに発見されていた63種の元素を8種類に分類して周期律表を提案しました。未発見の元素については空欄にして、化学的性質を予想していました。後に、空欄部分の元素Ga,Sc,Geなど、予測通りの性質をもつ元素が次々と発見されました。周期律表は、以後も改善作業が続きましたが、元素の謎の周期性は、20世紀に入ってから、量子力学によって原子核の構造、電子配置が解明されたことにより、説明されました。
1819年フランスのデュロンとプティが、多くの固体でモル比熱が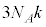 (k:ボルツマン定数、当時の言い方では
(k:ボルツマン定数、当時の言い方では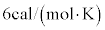 )になること(デュロン・プティの法則)を発見しました。
)になること(デュロン・プティの法則)を発見しました。
1834年、イギリスのファラデーが1モルの電子の電気量(ファラデー定数)を測定しました。後に、ファラデー定数をアボガドロ数で割って電気素量が決定されることになります。
ボイルの法則をニュートン力学に基づく流体力学によって導く試みは、既に18世紀前半にスイスのベルヌーイによって行われていましたが、1857年になってドイツのクラウジウスが気体分子運動論を展開、1860年にスコットランドのマクスウェルが気体分子の速度が正規分布に従う速度分布則を導出、さらに1866年、運動の自由度ごとに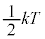 (T:絶対温度)というエネルギーを持つこと(エネルギー等分配則)を示しました。1871年にはオーストリアのボルツマンがデュロン・プティの法則をエネルギー等分配則に基づいて説明しました。その後、実験技術の進歩により、低温において、デュロン・プティの法則からずれて、固体の比熱が0に近づくことが明らかになってきました。1906年アインシュタインは、この事実についてプランクの量子仮説に基づく説明を行いました(固体比熱を参照)。1912年オランダのデバイがさらに固体比熱の厳密な説明を行いました。
(T:絶対温度)というエネルギーを持つこと(エネルギー等分配則)を示しました。1871年にはオーストリアのボルツマンがデュロン・プティの法則をエネルギー等分配則に基づいて説明しました。その後、実験技術の進歩により、低温において、デュロン・プティの法則からずれて、固体の比熱が0に近づくことが明らかになってきました。1906年アインシュタインは、この事実についてプランクの量子仮説に基づく説明を行いました(固体比熱を参照)。1912年オランダのデバイがさらに固体比熱の厳密な説明を行いました。
 1903年イギリスのJ.J.トムソンは原子の安定性から、右図のような正電気を帯びたスイカの中で種のように負電荷が分布している(トムソンの表現はぶどうパンの中にブドウが散在しているというもの)という原子モデルを提唱しました。
1903年イギリスのJ.J.トムソンは原子の安定性から、右図のような正電気を帯びたスイカの中で種のように負電荷が分布している(トムソンの表現はぶどうパンの中にブドウが散在しているというもの)という原子モデルを提唱しました。
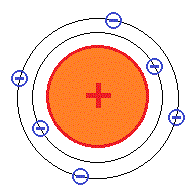 これに対して、1904年日本の長岡半太郎は、正電気を帯びた原子核の回りを負電荷を帯びた電子が回っているという土星型モデルを提案しました。
これに対して、1904年日本の長岡半太郎は、正電気を帯びた原子核の回りを負電荷を帯びた電子が回っているという土星型モデルを提案しました。
1909年のラザフォード散乱の実験(ニュージーランド出身、イギリスのラザフォードの指導下で、ガイガーとマースデンが、ラジウムから放出されたα線を金の原子核に衝突させ、その散乱の具合を調べた)により、ラザフォードは、原子の正電荷は原子の中心(原子の5000/1以下の半径の球の中)に集中し、原子の中はほぼ真空であるとし、惑星型原子モデル(但し原子核は長岡の土星型モデルよりずっと小さい)を支持しました(1911年)。
しかし、当時の電磁気学の理論によれば、荷電粒子は加速度運動する際に制動輻射と呼ばれる電磁波を放出してエネルギーを失うので、惑星型原子モデルでは、電子が電磁波を放出して中心に落ち込んでしまうことになり、あっという間にこの宇宙が崩壊することになってしまいます。しかし、原子は安定に存在し続けているわけで、惑星型モデルでは、原子の安定性が説明できませんでした。
これを解決したのが、ボーアの原子模型です。
【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。
物理基礎事項TOP 物理TOP TOPページに戻る
【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。
各問題の著作権は
出題大学に属します。©2005-2024(有)りるらる 苦学楽学塾 随時入会受付中!理系大学受験ネット塾苦学楽学塾(ご案内はこちら)ご入会は、
まず、こちらまでメールを
お送りください。